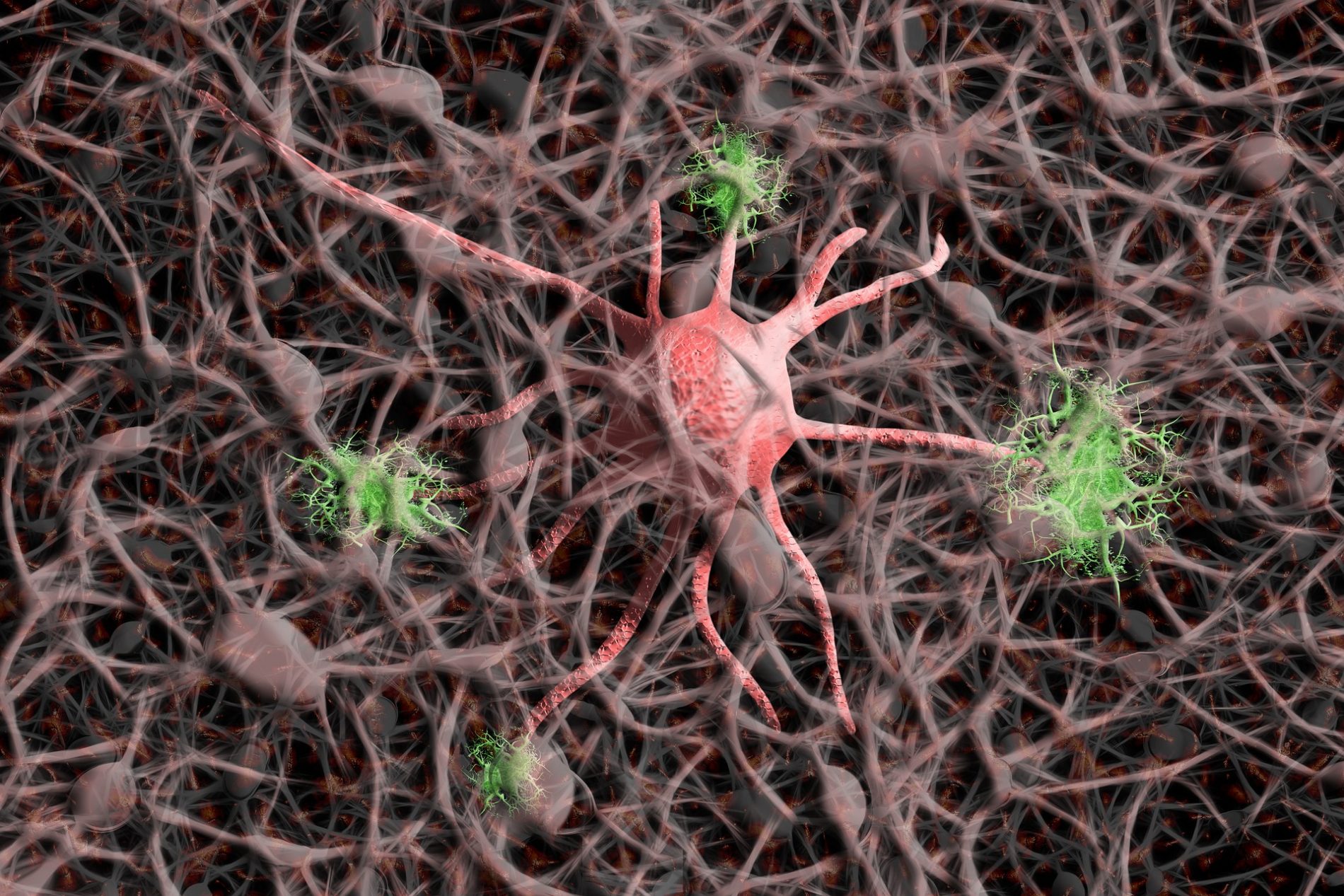
Wird das zentrale Nervensystem geschädigt, kann das verheerend sein. Nicht nur, da wir zum Leben maßgeblich auf seine Funktion angewiesen sind, sondern vor allem, weil Nerven nicht heilen. Somit führen Schädigungen an Gehirn oder Rückenmark oft zu lebenslangen Behinderungen wie zum Beispiel im Falle einer Querschnittslähmung. Ein Forschungsteam aus Bochum fand nun heraus, welcher Mechanismus im Nervensystem das Nachwachsen der Zellen verhindert.
Mehrere Faktoren relevant
Bisherige Forschungen konnten drei Ursachen ausfindig machen, die für die Heilungsunfähigkeit der Nerven verantwortlich sind: Eine unzureichende Aktivierung eines Regenerationsprogramms, die Bildung einer Narbe, die Nervenfasern nur schwer durchdringen können, sowie die hemmende Wirkung von Eiweißmolekülen auf die nachwachsenden Nervenfasern. Doch Prof. Dr. Dietmar Fischer, Leiter des Forschungsteams für Zellphysiologie an der Ruhr-Universität-Bochum, vermutete, dass das nicht alles sein kann: „Wenngleich man in den vergangenen Jahrzehnten experimentelle Ansätze gefunden hat, auf diese einzelnen Aspekte therapeutisch einzugehen, zeigten selbst kombinatorische Ansätze nur einen mäßigen Erfolg. Es muss also noch weitere, bisher unbekannte Ursachen dafür geben, warum Nervenfasern im ZNS nicht regenerieren.“ In einer Studie, die sie kürzlich im Fachjournal „Proceedings of the National Academy of Sciences“ veröffentlichten, gingen die Forschenden diesem Verdacht nach.
Überraschende weitere Ursache
Am Modell des Sehnervs untersuchte das Bochumer Forschungsteam, wie die Fasern auf Verletzungen reagieren. Dabei machten sie eine überraschende Entdeckung: Die Neuronen werden nicht etwa durch einen hemmenden Stoff an der Regeneration gehindert, sondern durch einen wachstumsfördernden Stoff. Dabei handelt es sich um ein sogenanntes Chemokin, genauer gesagt um CXCL12. Das Problem mit dem Molekül: Es unterstützt die Entwicklung der Fasern, indem es Nerven anzieht. „Das Protein fördert eigentlich das Wachstum von Axonen und lockt regenerierende Fasern an. Es ist also chemoattraktiv“, erläutert Prof. Fischer. Bei Schädigung des zentralen Nervensystems wird der Stoff allerdings an der Verletzungsstelle freigesetzt. Das führt dazu, dass verletzte Nerven sich wieder zurück in Richtung Lockstoff orientieren. Sie sind gefangen an der Verletzungsstelle.
Rätselraten um das mysteriöse Protein
Diese selbstzerstörerische Eigenschaft der Nerven entdeckten die Forschenden fast durch Zufall: Sie bemerkten die verblüffende Rolle von CXCL12, als sie in ihren Experimenten den Rezeptor des Chemokins ausschalteten. Auf diese Weise wurden die Nervenzellen blind für das Protein und seine anziehende Wirkung. „Überraschenderweise führte dies zu einem stark gesteigerten Faserwachstum in den verletzten Sehnerven, und Axone zeigten ein deutlich geringeres Zurückwachsen zur Verletzungsstelle“, schildert Dietmar Fischer. Das Forschungsteam untersuchte dann, wie es zu der Ausschüttung des Chemokins an der Verletzungsstelle kommt. Dabei stellte sich heraus, dass einige der Neuronen in der Netzhaut das Protein selbst produzieren und es bei Bedarf zum Unfallort transportieren. Dort wird es aus den durchtrennten Fasern, den Axonen, freigesetzt.
Ansätze für neue Medikamente
„Es ist noch völlig unbekannt, warum einige dieser Nervenzellen CXCL12 und andere den Rezeptor bilden“, so Fischer. „Wir kennen die physiologische Rolle des Proteins noch nicht, sehen aber, dass es für die Reparatur des Nervensystems sehr hinderlich ist.“ In weiteren Experimenten zeigten die Forschenden aber bereits, dass die Inaktivierung des Proteins selbst ebenfalls die Heilung der Nerven verbesserte. Zurzeit untersucht das Team, ob auf diese Weise auch andere Verletzungen des Gehirns und Rückenmarks gemindert werden können. „Diese neuen Erkenntnisse eröffnen uns nun die Möglichkeit, pharmakologische Ansätze zu entwickeln, die darauf abzielen, die Interaktion von CXCL12 und seinem Rezeptor auf den Nervenfasern zu stören, um diese aus ihrer Gefangenschaft an der Verletzungsstelle zu befreien“, erklärt Fischer.






Was meinen Sie?